白驹过隙,不经不觉,2022已过半。上半年我们一起接受了CSCO、ESMO、ASCO等重大会议的学术洗礼,收获了DESTINY、TROPICS等关键临床的飞跃进展,但也不得不迎来科学研究必须面对的“阴性结果”。
我们今天就来好好盘点上半年的“重磅爆阴”~
1
两大巨头接连翻船
口服SERD还能行吗?
今年3月,赛诺菲宣布口服雌激素受体降解剂(SERD) amcenestrant用于激素治疗前后进展的局部晚期或转移性ER+/ HER2-乳腺癌患者的AMEERA-3研究失败。与医生选择的内分泌治疗相比,amcenestrant单药治疗未达到改善无进展生存期(PFS)的主要终点,Amcenestrant因此也成为了首个在关键临床中披露阴性数据的口服SERD。

AMEERA-3是一项随机、开放标签、II期临床试验,旨在评估amcenestrant单药治疗vs医生选择的单药内分泌治疗(包括氟维司群、阿那曲唑、来曲唑、依西美坦以及他莫昔芬)在既往接受过激素治疗的ER+/HER2-局部晚期或转移性乳腺癌患者中疗效和安全性。研究的主要终点是由独立中心审查评估的PFS,研究的次要终点包括总生存期(OS)、客观缓解率(ORR)、疾病控制率(DCR)、临床获益率(CBR)、缓解持续时间(DoR)以及安全性和生活质量评估。
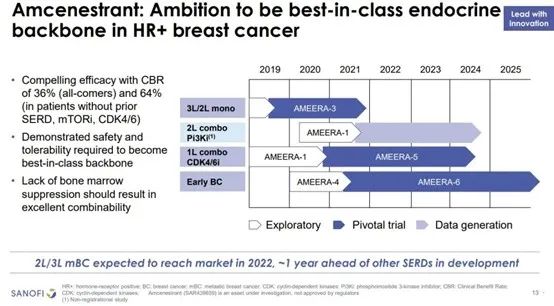
赛诺菲表示将继续评估AMEERA-3试验数据,并与研究人员合作公布完整结果。amcenestran联合palbociclib一线治疗ER+/HER2-MBC的AMEERA-5研究以及早期乳腺癌患者辅助治疗的AMEERA-6研究将继续进行。
无独有偶,4月25日,罗氏公布第一季度财报,同时该公司透露口服SERD giredestrant在acelERA试验中未能达到改善PFS的主要终点。

Giredestrant是罗氏开发的潜在BIC SERD,其临床前活性是其他SERD的7-15倍,包括氟维司群、camizestrant、amcenestrant、elacestrant。在目前的临床研究中,Giredestrant也是给药剂量最少的一款SERD。acelERA 研究的失利,让罗氏成为继赛诺菲之后,在SERD领域暂时折戟的第二家公司。
acelERA BC是一项随机、开放标签、多中心的II期研究。入组的303例患者为晚期ER+/HER2-乳腺癌,既往接受过≥2线治疗(必须包括内分泌治疗)。受试者分别接受giredestrant或医生选择的氟维司群或芳香化酶抑制剂作为二线或三线治疗。
在最新披露的信息中,Giredestrant未能超过医生选择的内分泌单药治疗所达到的无进展生存期,导致该研究错过了主要终点。即便如此,罗氏还是从试验中得出了一些积极的结论,并指出“疗效数据令人鼓舞,对雌激素受体活性依赖程度较高的患者获益更为明显。” 目前OS数据仍不成熟。
目前,Giredestrant仍在开展多项III 期研究,包括与哌柏西利联合作为HR+/HER2-晚期乳腺癌的一线治疗方案。
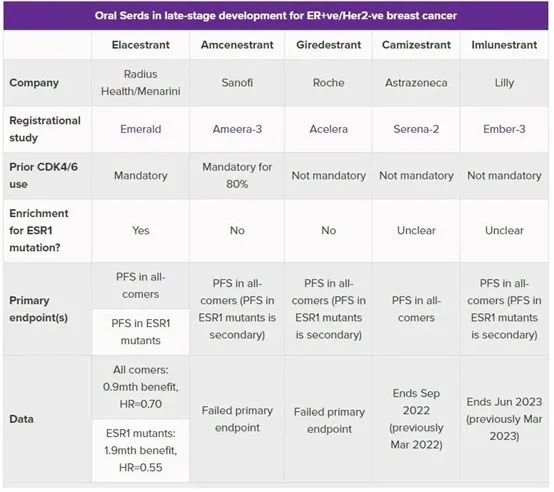
目前,全球批准上市的SERD药物只有氟维司群注射液一种,进入III期临床口服SERD药物有6款。“老大哥”艾拉司群(elacestrant)是第一个在关键试验中战胜氟维司群的口服SERD,但据EMERALD试验,全人群中mPFS延长不足1个月,目前而言在OS数据上也并没有显著优势。每日口服的SERD与每月注射一次的氟维司群最终结局如何,值得期待。
2
CDK4/6i首斩OS阴性结果
“领头羊”地位岌岌可危?
6月,辉瑞在2022 年美国临床肿瘤学会(ASCO)上公布了CDK4/6抑制剂哌柏西利(palbociclib)联合来曲唑与安慰剂联合曲唑相比,用于绝经后妇女的一线治疗ER+、HER2-转移性乳腺癌 (mBC)的7年半PALOMA-2随访数据。结果显示,哌柏西利并未在临床试验中改善新诊断的HR 阳性、HER2阴性乳腺癌患者OS。
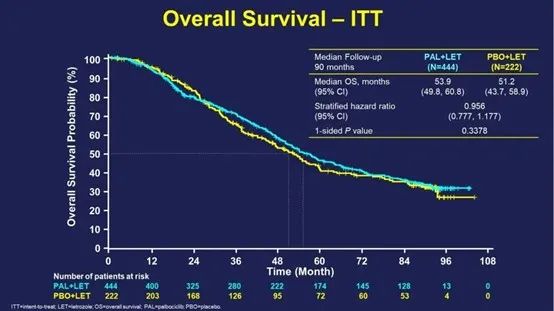
PALOMA-2是一项随机、双盲、III期临床研究,既往证实了相较安慰剂(PBO)+来曲唑,PAL+LET一线治疗ER+/HER2-晚期乳腺癌能显著改善PFS (中位PFS:27.6个月vs 14.5个月;HR=0.56 ,95%CI:0.46-0.69;P<0.0001)。
中位随访时间90个月后,总生存事件数为405(全体的60.8%),有相当比例的患者无法进行随访(撤回同意或失访)导致其数据删失。405例死亡中,PAL组和PBO组的中位OS分别为53.9个月(95%CI:49.8-60.8)和51.2个月 (95%CI:43.7-58.9)(HR=0.956,95%CI:0.777-1.177;分层单侧P=0.3378)。哌柏西利对比安慰剂,数值上显示出一定程度的总生存延长,但并未达到统计学差异。此次挫折也使哌柏西利成为唯一一款在III期临床试验中没有获得成功OS结果的CDK4/6抑制剂。
这并不是哌柏西利第一次在整体生存指标翻车。此前,哌柏西利已在PALOMA-3、PALLAS和PENELOPE-B等 III期试验中屡屡受挫。
3
通杀早晚期TNBC的PARPi
这回栽“队友”手里了?
5月4日,2022 ESMO乳腺癌大会报道了PARP1抑制剂奥拉帕利(Olaparib)联合ATR抑制剂ceralasertib或WEE1抑制剂adavosertib在二/三线治疗转移性三阴性乳腺癌(mTNBC)中的II期VIOLETTE临床研究最新结果。数据表明,无论是否存在同源重组修复(HRR)基因突变和BRCA突变,与奥拉帕利单药治疗相比,奥拉帕利+ceralasertib未能改善mTNBC患者的PFS(HR=0.79,P=0.18)。而对于奥拉帕利+adavosertib组,由于发生了超出预期的≥3级血液学毒性,已提前停药。
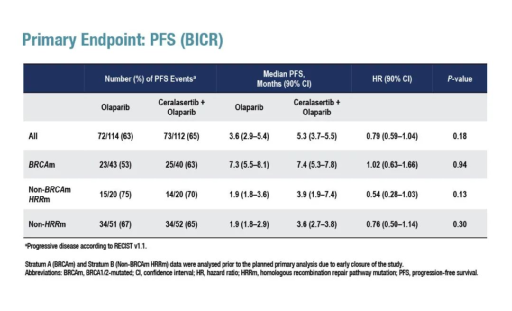
VIOLETTE研究是一项前瞻性、开放标签、随机、多中心II期研究,旨在评估靶向DNA损伤修复的药物(Ceralasertib或Adavosertib)联合奥拉帕利 vs 奥拉帕利单药治疗mTNBC患者的疗效和安全性。研究的主要终点是由独立中心审查评估的PFS,次要终点包括ORR、DoR、OS及耐受性和安全性评估。
但此次栽跟斗并不能掩盖在奥拉帕利在乳腺癌治疗领域的赫赫战功:在2018年1月12日,FDA批准奥拉帕利用于治疗既往经治进展的gBRCAm、HER2阴性转移性乳腺癌患者,正式向晚期乳腺癌发起挑战。而在2021年ASCO大会上,基于重磅研究OlympiA,奥拉帕利写入第五版2021NCCN指南,改变了现有的早期乳腺癌临床方案。
4
首个乳腺癌领域ICI
T药早晚期乳癌临床接连“遭锤”
2022年6月28日JCO在线发表了随机III期IMpassion050试验数据,结果令人大跌眼镜。临床前数据为癌症免疫治疗联合HER2靶向治疗HER2+乳腺癌提供了强有力的理论基础,且考虑到与晚期乳腺癌相比,早期乳腺癌(EBC)癌症免疫治疗预期会带来更大的好处。然而免疫检查点抑制剂(ICI)阿替利珠单抗并未带来pCR改善的结果,这可以说是大爆冷门了。

IMpassion050是一项双盲、随机、安慰剂对照研究,评价了新辅助阿替利珠单抗/安慰剂联合PH+化疗治疗高危HER2阳性EBC的疗效和安全性。主要终点是意向治疗人群(ITT)和PD-L1阳性人群的pCR率。次要终点包括PD-L1阴性肿瘤患者的pCR、无事件生存期(EFS)和安全性。
中位随访时间分别为15.7个月(阿替利珠单抗组)和15.9个月(安慰剂组)。阿替利珠单抗组的pCR率为62.4%,安慰剂组为62.7%(差异,-0.33%;95%CI,-9.23-8.57;P = .9551)。同样,对于PD-L1阳性肿瘤患者,阿替利珠单抗组的pCR率较低(64.2% vs 72.5%;差异,-8.26%;95%CI,-20.56-4.04;P = .1846)。
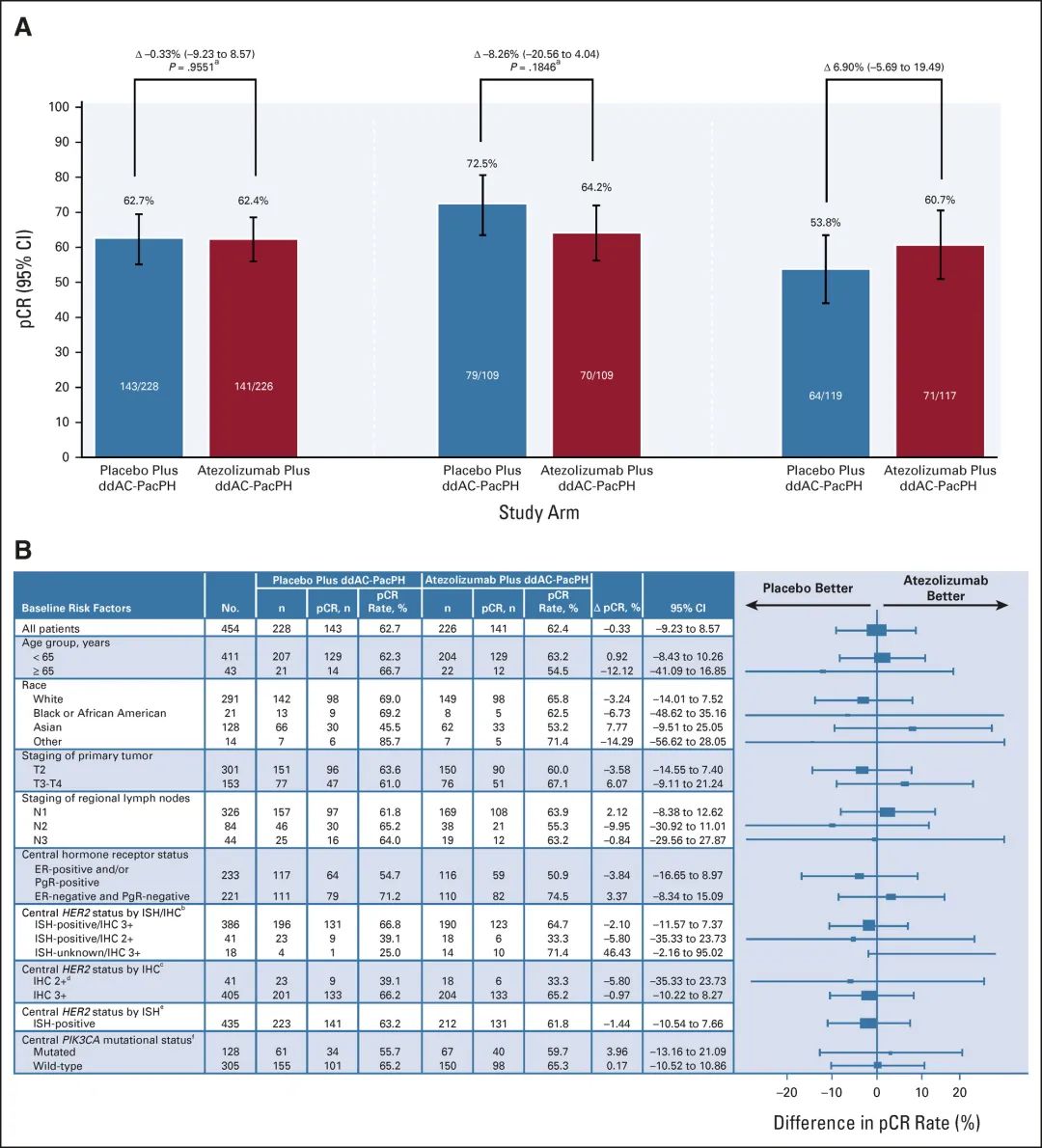
且与安慰剂组相比,阿替利珠单抗组中严重AE、3-4级AE和特别关注AE(AESI)的总发生率增加。
这也并不是阿替利珠单抗的首败。2020 年 8 月,罗氏公司宣布,与安慰剂加紫杉醇相比,评估阿替利珠单抗联合紫杉醇一线治疗转移性 TNBC 的 III 期 IMpassion131 研究未达到主要研究终点,宣告失败。2021 年 7 月,因阿替利珠单抗在主要研究中的作用不足以证明该药在三阴性乳腺癌与其他药物合用时效果良好,欧洲药品管理局(EMA)撤回了罗氏公司使用阿替利珠单抗联合白蛋白紫杉醇和蒽环类化疗在治疗早期或局部晚期TNBC的申请。
