CDK4/6抑制剂联合内分泌治疗已成为雌激素受体阳性转移性乳腺癌患者的首选治疗方法。然而,对CDK4/6抑制剂的先天抗性的预测性生物标志物和机制仍然很大程度上未知。
2022年8月30日,中国医学科学院/北京协和医学院马飞及李丹共同通讯在Molecular Cancer(IF=41)在线发表题为“S6K1 amplification confers innate resistance to CDK4/6 inhibitors through activating c-Myc pathway in patients with estrogen receptor-positive breast cancer”的研究论文,该研究共有36名接受palbociclib和内分泌治疗的患者作为发现队列纳入本研究。对这些患者的循环肿瘤DNA进行了下一代测序,以评估与对palbociclib(帕博西尼)的先天耐药性相关的体细胞改变。然后,候选生物标志物在另一个由104名患者和公开可用的数据集组成的独立队列中得到验证。
在发现队列中,S6K1扩增(3/35,9%)被确定为对CDK4/6抑制剂先天耐药的重要原因。在独立队列中,S6K1在15/104(14%)的患者中过度表达。在接受palbociclib治疗的患者中,高表达S6K1的患者的无进展生存期明显低于低表达S6K1的患者(风险比=3.0,P=0.0072)。
公开数据的荟萃分析显示,S6K1扩增的患者占乳腺癌的12%。S6K1高表达的乳腺癌患者的无复发生存率显著降低(风险比=1.31,P<0.0001)。在乳腺癌细胞中,由基因扩增引起的 S6K1过表达足以促进对palbociclib的耐药性。
从机制上讲,S6K1过表达增加了G1/S转换相关蛋白的表达水平和Rb的磷酸化,主要通过激活c-Myc途径。值得注意的是,这种抗性可以通过添加mTOR 抑制剂来消除,该抑制剂在体外和体内阻断S6K1的上游。
总之,该研究发现S6K1扩增是乳腺癌先天性对palbociclib耐药的重要机制。对于CDK4/6和S6K1拮抗剂的组合,可以考虑S6K1扩增的乳腺癌。

乳腺癌是全球女性最常见的恶性肿瘤,中国每年新增病例27.24万例。雌激素受体阳性 (ER+),人表皮生长因子受体2阴性 (HER2−) 乳腺癌是最常见的亚型,占转移性乳腺癌 (MBC) 的60%以上。细胞周期蛋白依赖性激酶4和6 (CDK4/6) 抑制剂,包括palbociclib、ribociclib和abemaciclib,已被证明可显著提高ER+HER2−MBC患者的无进展生存期 (PFS) 和总生存期 (OS)。因此,CDK4/6抑制剂联合内分泌治疗已成为ER+HER2−MBC患者最重要的治疗选择。
然而,耐药性的普遍存在降低了CDK4/6抑制剂治疗ER+HER2−MBC患者的效果。一些患者没有从CDK4/6抑制剂中获得任何益处,并且经常在3 个月内转换为其他疗法——定义为先天性耐药。为了在这些患者中选择更合适的治疗方案并避免palbociclib的不良事件,确定可以预测对palbociclib的先天耐药性的生物标志物至关重要。
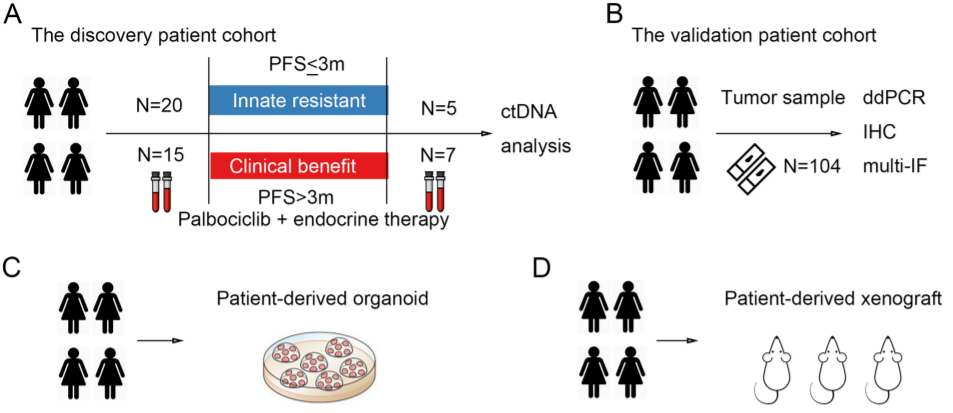
通过分析来自乳腺癌患者的ctDNA,探索与CDK4/6抑制剂先天耐药相关的关键基因(图源自Molecular Cancer )
不幸的是,几项大规模III期临床试验的生物标志物分析未能建立恒定的生物标志物来预测palbociclib (帕博西尼) 与内分泌治疗联合使用的疗效。从晚期患者身上获取转移组织相对困难,单个肿瘤部位的基因状态无法揭示肿瘤全身的基因全景。
重要的是,对循环肿瘤DNA (ctDNA) 进行基因分型有助于检测基因组改变的整体视图,尤其是在具有异质转移部位的患者中。
因此,该研究在真实世界的ER+HER2−MBC患者队列中进行了ctDNA测试,以寻找可以预测对CDK4/6抑制剂先天耐药的生物标志物,并在另一个独立的患者队列中验证了候选生物标志物。通过细胞实验,该研究检查了导致对CDK4/6抑制剂产生抗性的关键遗传异常的分子机制。此外,基于患者来源的类器官 (PDO) 和患者来源的异种移植物 (PDX) 研究的结果,该研究提出了一种潜在的治疗策略来克服对 CDK4/6抑制剂的先天耐药性。
原文链接:
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-022-01642-5
参考:Retraction
