致密的纤维化基质是造成胰腺癌的原因,胰腺癌的五年生存率仅为8%,因此具有致死性高且难以治疗。在三阴性乳腺癌患者中,研究表明,致密的基质与较差的生存率和较高的复发率有关。
所有实体瘤都会形成与癌症相关的成纤维细胞,因为其会促进血管生成或新血管的发育。血管生成在癌症扩散中起着重要作用,因为实体瘤需要血液供应才能生长。
但是在胰腺癌和三阴性乳腺癌中,形成的基质是非常致密,通常没有办法让常规药物穿透它并有效地治疗癌症。
在实体瘤中形成的基质还可以帮助肿瘤逃避人体的免疫系统。免疫疗法是一种利用人体自身的免疫系统抵抗癌症的治疗方法,对由致密的基质(富含与癌症相关的成纤维细胞)保护的肿瘤效果较差。
基于此,佐治亚州立大学生物学教授刘志仁及其团队开发的ProAgio药物可有效治疗胰腺癌并延长小鼠的生存期,该药还可以有效治疗三阴性乳腺癌,其研究成果分别发表在《Cellular and Molecular Gastroenterology and Hepatology》和《Journal of Experimental Medicine》杂志上。


由人蛋白质产生的ProAgio靶向细胞表面受体整联蛋白αvβ3,其在与癌症相关的成纤维细胞上表达。成纤维细胞是产生胶原蛋白和其他纤维分子的细胞,可被肿瘤动员起来,形成厚实的物理屏障(称为基质),可保护癌症并帮助其生长。该药物通过在表达整联蛋白αvβ3的癌症相关成纤维细胞中诱导细胞凋亡或程序性细胞死亡而起作用。
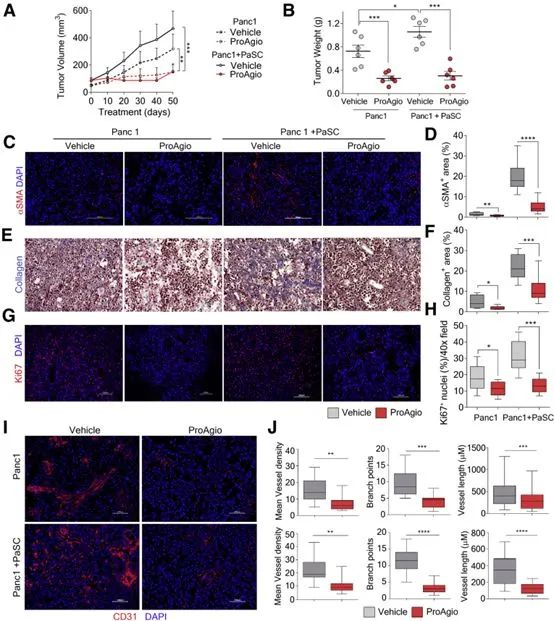
ProAgio靶向整合素αvβ3抑制肿瘤生长并提供生存益处
在这两项研究中,该研究团队表明ProAgio对肿瘤脉管系统具有深远的影响。就胰腺癌而言,它会重新开放由于致密基质造成的高血管外压力而塌陷的血管。在三阴性乳腺癌的情况下,该药物的抗血管生成活性减少了不规则的、渗漏的血管生成。在这两种情况下,ProAgio都可以有效地治疗癌症。

ProAgio打开塌陷的肿瘤血管,增加药物输送
ProAgio药物的独特之处在于它仅靶向与癌症相关的成纤维细胞(也就是不活跃的成纤维细胞),成纤维细胞是活跃参与支持癌症的细胞的亚类。这中特效极大地减少了药物的副作用并提高了效力。
在我们受伤时,在有伤口的地方,正常的成纤维细胞会分泌纤维以限制损伤并促进愈合。然而肿瘤区域如果出现伤口的话基本上是不会愈合的。静止的成纤维细胞可能在阻止癌症扩散中发挥作用。但同时也会阻止药物的进入,从而影响治疗。我们要做的就是把这些不好的成纤维细胞杀死,而尽量避免损伤好的成纤维细胞。
ProAgio已获得由刘教授创立的制药研究公司ProDa BioTech的许可。2018年,ProDa BioTech从美国国家癌症研究所(National Cancer Institute)获得了200万美元的资助,用于将药物转移至早期临床试验之前所需的毒理学和药代动力学研究。这些研究已经完成,该公司已提交了新药研究(IND)申请,这是美国食品和药物管理局(FDA)批准的将ProAgio应用于人类受试者的授权申请。一旦获得IND许可,下一步就是立即开始临床试验。这项确定患者耐受性和II期推荐剂量的首次试验将于2021年初在马里兰州贝塞斯达(Bethesda)的美国国立卫生研究院临床中心开始,并由美国国立癌症研究所的肿瘤学家Christine Alewine博士领导。埃默里大学(Emory University)将于2021年下半年开始对乳腺癌和胰腺癌患者进行多站点试验。
这两项研究表明,ProAgio是一种有效的胰腺癌治疗药物,因为它特异性地耗尽CAPaSC,消除肿瘤血管生成,从而增强胰腺癌的药物输送和Gem疗效。同时在三阴性乳腺癌小鼠模型中,ProAgio耗尽CAFs、减少缺氧、减少赖氨酰氧化酶(LOX)的分泌、减少转移,为其提供生存益处。
参考文献
1、Sharma M , Turaga RC et al. Simultaneously targeting cancer-associated fibroblasts and angiogenic vessel as a treatment for TNBC. J Exp Med. 2021 Apr 5;218(4):e20200712. doi: 10.1084/jem.20200712. PMID: 33561195; PMCID: PMC7876552.
2、Turaga, Ravi Chakra et al. “Modulation of Cancer-Associated Fibrotic Stroma by An Integrin αvβ3 Targeting Protein for Pancreatic Cancer Treatment.” Cellular and molecular gastroenterology and hepatology vol. 11,1 (2021): 161-179. doi:10.1016/j.jcmgh.2020.08.004
参考:生物谷
