细胞周期抑制剂改善了雌激素受体阳性乳腺癌患者的生存质量及预后。雌激素受体低表达作为雌激素受体阳性乳腺癌的一种类型,不同于雌激素受体高表达,其内分泌治疗效果差。
随着检测技术的发展和耐药机制的研究,雌激素受体低表达患者的流行病学、临床病理特征以及治疗策略越来越多引起关注,本文将就雌激素受体低表达乳腺癌的研究进展进行综述。
雌激素受体(estrogen receptor,ER)作为乳腺癌的生物学标志物,影响着乳腺癌内分泌治疗的选择。美国临床肿瘤学会和美国病理学家学会(American Soci ety of Clinical Oncology/College of American Patho logists,ASCO/CAP)指南(2010年)将ER≥1%定为 ER阳性,ER<1%定为ER阴性。ASCO/CAP指南(2020年)中,新增ER在1%~10%定为ER低表达 ER>10%定为ER高表达。
ER低表达乳腺癌,作为种特定表达形式,其生物学特征与ER阴性相似ER阳性乳腺癌除从5~10年内分泌治疗获益外2,针对人类表皮生长因子受体-2(human epidermal growth factor receptor,HER-2)周期蛋白依赖性激酶4/6(cyclin-dependent kinases 4and,CDK4/6)的靶向药物、针对PIK3CA基因突变的选择性磷脂酰肌醇3-激酶(PI3K)抑制剂阿培利司以及靶向BRCA胚系突变的PARP抑制剂等药物也给患者带来生存改善。
ER阳性乳腺癌的治疗策略能否直接用于ER低表达乳腺癌,目前尚无定论。因此,本文将对 ER低表达乳腺癌的研究进展进行综述。ER表达的发展及生物学特征,ER表达的发展在细胞膜、细胞质、线粒体和细胞核均有表达最初用于测定ER表达的方法是配体结合试验(lig and bindingassay,LBA)。
随后Harvey等证实:相对LBA,免疫组织化学法(immunohistochemistry,IHC)测定ER能同等或更好地预测内分泌治疗的效果,日更为安全便利,至20世纪90年代IHC逐渐替代LBA,ER阳性乳腺癌适合行内分泌治疗,但在不同研究中,ER阳性的界值从1%~20%不等4。
一项纳人绝经前乳腺癌的研究中,将ER>10%定义为ER阳生。Viale等也将ER≥10%定义为ER阳性。ER>10%作为ER阳性的界值逐渐被认可。ASCO/CAP指南(2010年)修订ER阳性为ER表达≥1%,ER阴性为ER表达<1%。
此外,Gnant等根据ER表达量对ER阳性患者进行分组,ER表达为10%~50%定义为低表达。51%~80%为中表达,81%~100%为高表达。Viale等根据ER表达量行亚组分析发现,ER为阴性 ER为1%~9%ER>10%三类患者的无病生存期(disease-free survival,DFS)差异具有统计学意义(P<0.05),而该研究中ER表达为1%~9%患者为44例。
一项9 636例的回顾性研究发现,250例患者(2.6%)ER表达为1%~9%。因此,仅以1%作为 ER阳性界值预测内分泌疗效尚有不足,尤其是ER低表达患者。ASCO/CAP指南(2020年)晚期乳腺癌国际共识指南第五版(ABC5)中国临床肿瘤学会(CSCO)乳腺癌诊疗指南(2021年)将ER表达在1%~10%定为ER低表达(弱阳性),见表1。

1.2 ER表达的生物学特征
ER和孕激素受体(progesteronereceptor,PR)是核受体超家族,在ER阳性绝经前或围绝经期乳腺癌中,PR低表达患者能从化疗中受益;ER阳性 PR阴性是乳腺癌复发高危因素。研究显示,ER低表达与ESR1基因突变或拷贝数变异相关1NF-KB的激活调控ER表达下调1。
2 ER低表达的流行病学、临床病理特征及相关生物标记物
2.1 流行病学特点
ER阳性乳腺癌中,ER低表达患者占2%~5%,在纳人2 162例病理分期为Tis期和T1期的乳腺癌中,ER低表达占2.5%。一项33 366例HER-2阴性乳腺癌的研究发现,HR低表达占2%。
在韩国的研究中,纳入5 930例乳腺浸润性导管癌或小叶性癌患者,ER低表达约占2%。另一研究显示,纳人ER阳性/HER-2阴性乳腺癌1 573例,ER低表达约占3%。在中国ER阳性/HER-2阴性患者的小样本中 ER低表达占5%。
2.2 临床病理特征
研究显示,ER低表达与ER阴性或基底样乳腺癌的分子特征相似。有研究发现,ER低表达患者的年龄、种族、家族史、肿瘤大小、分期或肿瘤分级等与三阴性乳腺癌(triple-negative breast cancer,TNBC)患者比较差异无统计学意义(P>0.05)且与TNBC胚系突变相似,BRCA1/BRCA2是最常见的突变基因也有研究发现,ER低表达与ER阴性患者的年龄、肿瘤大小、HER-2表达等相似。
但ER低表达患者的临床病理特征有别于ER阴性或ER高表达者。ER低表达较ER10%患者的年龄更小,分期更晚的比例更高(临床分期Ⅱvs.I期为61.6%vs43.7%);与 ER阴性相比,ER低表达分期更早。一项欧洲的研究发现,ER低表达较ER阴性患者的导管癌比例更少组织学分级G3期更少,Ki-67表达更低。
另有研究显示,ER阴性较ER低表达患者的分化更差,一项纳人2 162例乳腺癌的研究发现,与ER高表达相比,ER低表达患者的组织学分级更美、Ki-67表达更高,PR阴性比例更高;与ER阴性患者相比 ER低表达患者更年轻 组织学分级更好Ki-67表达更低,PR阳性比例更高。
一项465例早期乳腺癌包括25例ER低表达患者的研究发现约有1/4ER低表达患者的ESR1mRNA表达呈阳性,ER高表达患者的 ESR1mRNA表达高于ER低表达和ER阴性患者。HER-2阳性及生物标记物Finn等研究发现,在转移性ER阳性/HER-2
阴性乳腺癌中,ER低表达可作为标志物,预测拉帕替尼联合内分泌方案的疗效。
与ER高表达和ER阴性相比,ER低表达中HER-2阳性表达比例更高5;ER低表达患者中的HER-2阳性表达比例高于ER高表达比例(27.6%vs13.1%),ER低表达作为生物标记物能预测乳腺癌患者的病理完全缓解(pathological complete response,PCR)。
研究显示,在ER低表达患者中TP53蛋白表达更高。HR阴性乳腺癌BRCA1/2突变率为36.1%;HR低表达乳腺癌BRCA1/2突变率为39.5%,HR低表达和HR阴性乳腺癌的BRCA1/2突变率相近。
3 ER低表达乳腺癌的治疗及预后
3.1 内分泌治疗
2005年国际乳腺癌研究小组将乳腺癌分为内分泌治疗敏感型(内分泌治疗改善预后)内分泌治疗不敏感型(ER不表达或阴性)和内分泌疗效不确定型(ER低表达或ER表达不明显,内分泌效果不确定,常需化疗)。
研究发现,ER低表达乳腺癌患者受益于内分泌治疗,但治疗效果较ER高表达者差7。新辅助化疗后,相较于ER高表达乳腺癌,ER低表达患者 DFS 和总生存时间(overallsurvivalOS)更短,在ER低表达乳腺癌中,未行内分泌治疗89例行2~3年内分泌治疗185例。
行5年内分泌治疗360例患者的结果显示,2~3年与5年内分泌治疗患者的DFS差异无统计学意义(P>0.05),均优于未行内分泌治疗的患者,2~3年短程或5年行内分泌治疗均是可行的治疗方案。
3.2 其他药物治疗
卵巢功能抑制(ovarianfunction suppression,OFS剂常用于绝经前女性乳腺癌患者治疗,OFS提高了患者(ER或PR>10%)的8年DFS和OS但夫包括ER低表达者。在绝经前(尤其育龄期)的女性乳腺癌中化疗可致卵巢功能不全,进而增加女性不孕、骨质疏松、认知障碍、心血管疾病等风险,而OFS可保护卵巢功能,进而降低以上风险。
在ER阳性/HER-2阴性的转移性乳腺癌中 CDK4/6抑制剂联合内分泌治疗已成标准一线方案[30]该研究显示,在早期乳腺癌中,新辅助或辅助内分泌治疗也给患者带来生存获益,如MonarchE试验中阿贝西利、PALLAS试验中哌柏西利用于辅助内分泌治疗以及FELINE试验中瑞博西尼用于新辅助内分泌治疗。
CDK4/6联合内分泌治疗中,ER低表达患者的生存获益是否等同ER阳性尚无预设试验佐证,治疗选择上还需谨慎。一项III期随机临床试验发现,低剂量口服环磷酰胺未能改善ER低表达和TNBC患者的DFS。
3.3 早期乳腺癌预后
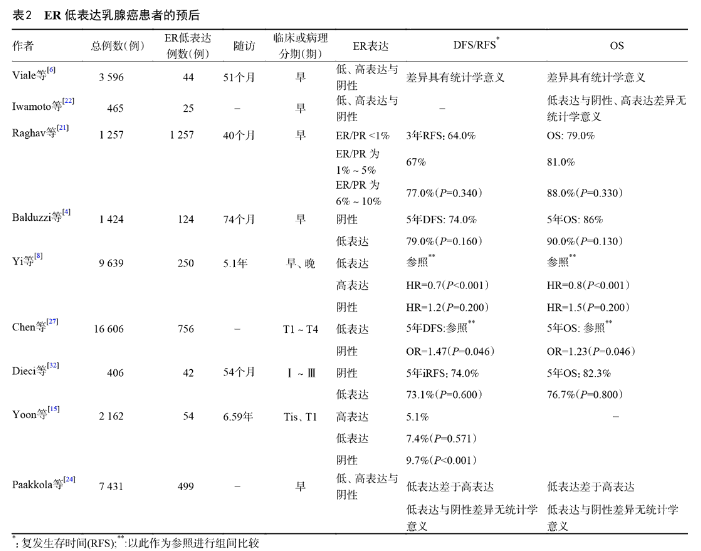
一项纳人360例早期乳腺癌的研究显示,ER低表达和ER阴性患者的3年DFS和OS差异无统计学意义(P>0.05)。另有研究发现,ER阴性与ER低:表达乳腺癌患者的5年DFS(74%vs79%)和OS(86%vs90%)差异无统计学意义(P>0.05)。
一项42例 ER低表达早期乳腺癌的研究发现,ER低表达和ER阴性患者的5年DFS和OS差异无统计学意义(P>0.05)。研究显示,ER低表达患者的OS优于ER阴性,差于ER高表达者Viale等研究发现 ER高表达患者的预后优于ER阴性患者,ER低表达与ER阴性或ER高表达患者的预后差异无统计学意义(P>0.05)。
在病理分期为Tis期和T1期乳腺癌中 ER低表达与ER高表达患者的5年DFS差异无统计学意义(P>0.05),但ER阴性者的5年DFS比ER高表达者差15。
也就是说,ER低表达在不同乳腺癌患者中的预后不同。也有研究未根据早、晚期乳腺癌进行分期。一项9 636例早、晚期乳腺癌的研究中,ER低表达患者的无远处转移生存期、DFS和OS均差于ER>10%的患者,但ER低表达和ER阴性患者的 DFS相似。
2018年一项荟萃分析显示ER低表达乳腺癌患者较ER阴性有更佳的5年DES和OS日相对ER>10%ER低表达乳腺癌者的内分泌治疗效果差,是否行内分泌治疗不影响ER低表达乳腺癌患者的预后。
2021年一项荟萃分析显示,ER低表达比ER高表达患者有更高的pCR率(24.8%vs.8.3%),但与ER阴生患者的pCR率相近,与ER高表达相比,ER低表达乳腺癌患者的DFS和OS更差,而ER低表达与ER阴性患者的预后相近。见表2。
4 结语
在ER阳性乳腺癌中,针对HER-2 CDK4/6 PIK3CA等靶点的药物改善了患者预后,但上述策略用于治疗ER低表达乳腺癌的证据尚有不足。目前 ER低表达患者的治疗证据多来自临床试验的亚组分析、回顾性研究或荟萃分析。考虑到ER低表达乳腺癌不同的生物特征,建议在ER低表达乳腺癌患者的治疗中,应在多学科模式下,整合患者HER-2状态年龄、基因突变等生物学特征,制定更优化的治疗策略。
参考:
[1] Yu KDCai YW,Wu SY,et al.Estrogen receptor-low breast cancer biology chaos and treatmentparadox[J].Cancer Commun(Lond)202141(10):968-980.
[2] Burstein HJ.Systemic therapyforestrogenreceptor-positiveHER2 negative breast cancer[J].N Eng J Med,202383(26):2557-2570.
[3] Harvey JM, Clark GM, Osborne CK,et al. Estrogen receptor status by immunohisto chemistry is superior to the ligand-binding assay for predicting response to adjuvant endocrine therapyin breast cancer[J].J Clin Oncol199917(5):1474-1481.
[4] Balduzzi A, Bagnardi VRotmensz N,et al.Survival outcomes in breast cancer patients with lowestrogen/progesterone receptor expression[J]. Clin Breast Cancer2014,14(4):258-264.
[5] Gnant M,Mlineritsch B,Schippinger Wet al.Endocrine therapyplus zoledronic acid in premenopausal breast cancer[J].N EnglJ Med,2009:679-691.
[6] Viale GRegan MMMaiorano E,et al.Prognostic and predictive value of centrally reviewed expression of estrogen and progester one receptors in a randomized trial comparing letrozole and tamoxifen adjuvant therapy for postmenopausal early breast cancer: big 1-98[J]. Clin Oncol,2007,25(25):3846-3852.
[7] Hammond MEH,Haves DFDowsettMet al.American Societv of Clinical Oncology/College of American Pathologists guideline re commendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer[J]. JClin Oncol,2010,28(16):2784-2795.
[8] Yi M, Huo L, Koenig KB,et al. Which threshold for ER positivity?a retrospective study based on 9639 patients[J]. Ann Oncol,2014,25(5):1004-1011.
[9] Fei F, Siegal GPWeiS.Characterization of estrogen receptor-low positive breast cancer[J]. Breast Cancer Res Treat2021188(1):225-235.
[10] Li ZWei HRLi SY,et al.The role of progesterone receptors in breast cancer[J].Drug Des Devel Ther,2022,16:305-314.
[11] van Laere SJ,van der Auwera lvan den Eynden GGetalNF kappaB activation in inflammatory breast cancer is associated with oestrogen receptor downregulationsecondarytoEGFRand/or ErbB2 overexpression and MAPK hyperactivation[J].BrJCancer,2007,97(5):659-669.
[12] Allison KH,Hammond MEH,Dowsett Met al.Estrogen and progesterone receptor testing in breast cancer:ASCO/CAP guideline update[J].J Clin Oncol2038(12):1346-1366.
[13] Caruana DWeiWMartinez-Morilla Set al.Association between
low estrogen receptor positive breast cancer and staining per- formance[J].NPJ Breast Cancer20206:5.
[14] Lovejoy LA,Turner CE,Wells JMet al.Heritability of low ER staining/HER2-breast tumors: are we missing an opportunity for ger mline testing[J]? Genes20211(12):1469.
[15] Yoon KH,Park YKang E,et al.Effect of estrogen receptor expression level and hormonal therapy on prognosis of early breast can cer[J].Cancer Res Treat,2021[Ahead of print].
[16] Schrodi S,Braun MAndrulat Aet al.Outcome of breast cancer
patients with low hormone receptor positivity:analysis of a 15 year population-based cohort[J]. Ann Oncol202132(11):14101424.
[17] ParkYHKarantza VCalhounSRet alPrevalencetreatment patterns, and prognosis of low estrogenreceptor-positive(1% to10%) breast cancer: a single institutions experience in Korea[J] Breast Cancer Res Treat,2021,189(3):653-663.
[18]Purrington KS,Gorski DSimon Msetal.Racial differences in estrogen receptor staining levels and implications for treatment and survival among estrogen receptor positiveHER2-negative invas ive breast cancers[J].Breast Cancer Res Treat2020181(1):145154.
[19] Zhang LH,Song GH,Shao B,et al.The efficacy and safety of palbociclib combined with endocrine therapy in patients with hor mone receptor-positive HER2-negative advanced breast cancer:a multi-center retrospective analysis[J]. Anticancer Drugs202233(1):e635-e643.
[20] Poon IK,Tsang JY,Li J,et al.The significance of highlighting the oestrogen receptor low category in breast cancer[J].Br JCancer2020123(8):1223-1227.
[21] Raghav KPS,Hernandez-Aya LFLei Xet al.Impact of low estrogen/progesterone receptor expression on survival outcomes in breast cancers previously classified as triple negative breast can cers[[].Cancer2012118(6):1498-1506.
[22] lwamoto T,Booser DValeroVet al.Estrogenreceptor(ER)mRNA and ER-related gene expression in breast cancers that are 1%to10% ER-positive byimmunohistochemistry[J].J Clin Oncol201230(7):729-734.
[23] Finn RS,Press MF,Dering Jet al.Quantitative ER and PgR assessment as predictors of benefit from lapatinib in postmenopausa women with hormone receptor-positiveHER2-negativemetastat ic breast cancer[J].Clin Cancer Res201420(3):736-743.
[24] Paakkola NM,Karakatsanis AMauri Det al.The prognostic and
predictive impact of low estrogen receptor expression in early breast cancer: a systematic review and meta-analysisJ].ESMO Open,20216(6):100289.
[25] deWitte HH,Foekens JA,Lennerstrand Jet alPrognostic significance of TP53 accumulation in human primary breast cancer:com parison between a rapid quantitative immunoassay and SSCP ana lysis[J].Int Cancer,1996,69(2):125-130.
[26] Sanford RASong JGutierrez-Barrera AMet alHigh incidence of
germline BRCA mutation in patients with ERlow-positive/PRlow positive/HER-2 neu negative tumors[J].Cancer2015121(19)3422-3427.
[27] Chen TZhang NMoran MSet al.Borderline ER-positive primary
breast cancer gains no significant survival benefit fromendocrine therapy: a systematic review and meta-analysis[J].Clin Breast Can cer,2018,18(1):1-8.
[28] CaiYWShao ZMYu KD.De-escalation of five-year adiuvant endocrine therapy in patients with estrogenreceptor-low positive(im munohistochemistry staining1%-10%breast cancer:propensity matched analysis from a prospectively maintained cohort[J].Can cer,2022,128(9):1748-1756.
[29] Francis PA,Pagani O,Fleming GFet al.Tailoring adjuvant endocrine therapy for premenopausal breast cancer[1].N Engl JMed,2018,379(2):122-137.
[30] Braal CLJongbloed EMWilting SMet alInhibitingCDK4/6in
breast cancer with palbociclibribocicliband abemaciclib:similar ities and differences[J].Drugs,2021,81(3):317-331.
[31] ColleoniM,Gray KPGelber Set al.Low-dose oral cyclophosph amide and methotrexate maintenance for hormone recep tor -negative early breast cancer:International Breast Cancer Study Group Trial22-00[J]. JClinOncol,2016,34(28):3400-3408.
[32] Dieci M VGriguolo GBottosso M,et al.Impact of estrogen re
ceptor levels on outcome in non-metastatic triple negative breast cancer patients treated with neoadjuvant/adjuvantchemother apy[J].NPJ Breast Cancer,2021,7(1):101.
通信作者:袁芃(yuanpeng01@hotmail.com)
原文标题:雌激素受体低表达乳腺癌的研究进展
原文参见:中国肿瘤临床.2022;49(11):588-592.
