【摘要】 近年来,不断有新上市的抗人表皮生长因子受体 2(HER2)靶向药物在临床应用,对医护人员靶向药物的规范使用及管理提出了新的要求,而可及性靶向药物的输注规范、不良反应的预防和管理等是保证药物疗效及安全的重要前提。基于此,中国医药教育协会乳腺癌个案管理师分会及靶向药物输注规范共识制定小组就目前国内可及的注射用曲妥珠单抗 440 mg/瓶、150 mg/瓶、60 mg/瓶,帕妥珠单抗 420 mg/瓶、恩美曲妥珠单抗 100 mg/瓶、160 mg/瓶的药物为例,以及已发表《乳腺癌靶向药物静脉输注规范专家共识》推广、应用中存在的共性问题,通过改良德尔菲法,征集专家建议, 形成共识推荐意见,为《共识》进行了更新,为医护人员在靶向治疗管理的临床实践中提供参考。
【关键词】 乳腺肿瘤; 分子靶向药物; 上市新药; 改良德尔菲法; 更新
乳腺癌具有一定的异质性,不同分子亚型的治疗手段和预后均存在差异,尤其是人表皮生长因子受体 2(human epidermal growth factor receptor 2,HER2)阳性的患者,预后较差[1‑2]。近年来,随着HER2靶向药物临床研究不断取得突破进展,改变了 HER2 阳性乳腺癌患者的诊疗模式。治疗策略和诊疗方式的改变,对医护人员药物静脉输注精准管理提出了更高的要求,为了确保安全、优质的临床护理,医护人员需要了解抗体在细胞中的作用机制,了解如何确定生物疗法的最佳受试者,以及如何处理药物静脉输注过程中的相关事件,从而降低并发症的发生,获得患者满意度。
基于以上背景,为了更好地规范临床靶向药物静脉输注规范,本共识制定小组组织国内靶向药物静脉输注及乳腺癌领域相关专家,借鉴国内外指南推荐、相关文献和循证证据,结合国内实际情况,以曲妥珠单抗、帕妥珠单抗、恩美曲妥珠单抗 3 种靶向药物为例,发表了《乳腺癌靶向药物静脉输注规范专家共识》(以下简称《共识》)[3]。
随着 HER2靶向药物不断研究发展,靶向药物静脉输注的新理论、新技术、新方法也持续更新,医护人员必须及时了解和熟悉新上市靶向药物的静脉输注规范,确保靶向药物静脉输注的安全和有效性。本共识制定小组通过改良德尔菲法,召开线上线下讨论会,就不同规格乳腺癌靶向药物输注要求以及《共识》推广、应用过程中存在的共性问题,征集专家建议,对于有争议但缺乏循证证据的观点,我们采取专家投票方式形成共识推荐意见,包括不同规格曲妥珠单抗输注规范、即配即用原则、复输流程、静脉输注配制无菌规范、余液管理等。旨在对《共识》进行更新,就靶向药物的可及性,供广大医护人员在靶向药物静脉输注精准管理的临床实践中参考。
一 、靶 向 药 物 使 用 标 准 作 业 流 程(standardoperating procedure,SOP)
(一)靶向药物的配置SOP
考虑到不同级别医院配置、输注条件不同,结合实际情况,靶向药物的配置SOP从病房配置SOP和 静 脉 药 物 配 置 中 心(pharmacy intravenous admixture service,PIVAS)配置 SOP 两个方面进行了阐述。具有 PIVAS 条件的医院,应严格执行PIVAS配置SOP。
1. 病房配置 SOP:严格执行双人核对,单双人签字的操作流程。病房配置SOP见图1。
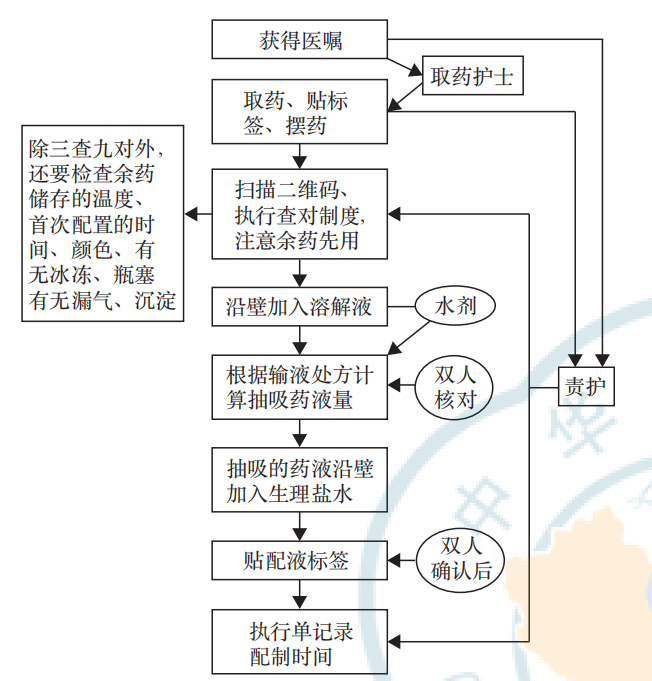
图1 靶向药病房配置标准作业流程图
2. PIVAS配置 SOP[4]:若医院配置有 PIVAS,应严格执行 PIVAS 配置 SOP。PIVAS 配置 SOP 流程图见图2。
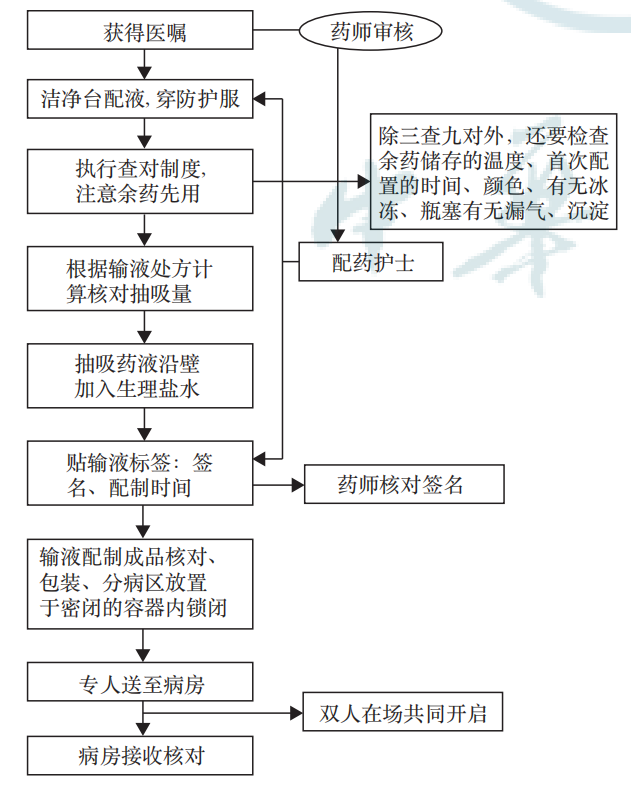
注:依据《静脉用药集中调配质量管理规范》卫生部办公厅文件卫办医政发(2010)62号
图2 静脉药物配置中心标准作业流程图
3. 靶向药物输注 SOP(遵循静脉输液流程):
(1)评估患者并告知注意事项,急性反应的敏感症状,如寒战、发热、皮肤瘙痒、呼吸困难等症状;
(2)根据药物选择输液装置;(3)将药物配好,携药物到床旁;
(4)使用腕带核对患者信息、药物信息;
(5)选择血管、消毒、穿刺(按留置针穿刺流程进行)、核对;
(6)生理盐水建立静脉通路,预处理30 min 后,输注靶向药物;
(7)首次输注,给予心电监护;
(8)调节滴速:根据评估结果调节;
(9)核对、观察患者反应。
(二)急性反应应急预案SOP
药物输注过程中,如果患者发生输注反应,应采取图3所示应急预案,丢弃的药物按余药处理流程进行(图4)。
(三)复输输注SOP
经医生确认患者输注反应症状消失,可以进行复输,护士获得医嘱后,取出药物,自然复温,进入输注流程,调节滴速 10 滴/min,20 min 后无输注反应,调节滴速 20 滴/min;过 20 min 后无输注反应调节滴速 40 滴/min;再过 20 min 后仍无输注反应,调节滴速 60~80滴/min直至滴完(根据患者实际情况调节)。全程心电监护、做好抢救准备。剩余药物按余药管理流程处理(图4)。
(四)余液管理SOP
在临床使用中根据患者的体重在选择 440 mg(20 ml)/瓶规格曲妥珠单抗时,会有余液产生,且共识小组投票一致认为余液需妥善保存。为避免440 mg(20 ml)/瓶规格曲妥珠单抗余液保存不当失效,不建议由患者自行保存。此规格的曲妥珠单抗余液建议遵循以下方法保存[5]。
1. 使用无菌敷贴封闭剩余药液瓶口,药品外层使用透明敷料整体封好,使药品处于无菌密闭状态,重新放入原包装盒内。
2. 使用油性笔在包装上标记以下信息:患者姓名、性别、年龄、住院号、已经使用药液的具体剂量数和剩余药液的具体剂量数、开封日期、失效日期、下次应执行的日期和患者的电话号码。
3. 病房护士和患者双方均核对后签名,放入专柜保存。
4. 病房护士将剩余药物信息在《药品使用登记本》上登记,记录应清晰,规范并有签名;内容应全面,包括患者床号、姓名、住院号、电话号码、使用了的药品剂量、剩余剂量和失效日期。
5. 病房护士每日交接班需清点剩余药品,并签名,清点登记内容包括:药品的名称、剂量、批次及存放药品的数量,并在《交接班登记本》上登记。
6. 每班护士清点药品时,需检查冰箱是否正常运行,温度是否在规定范围内等情况并签名,如发现异常情况及时处理。
7. 冰箱定期清洁除霜一次,确保冰箱的干净整洁,以免影响冰箱的冷藏效果。每周对药品进行检查,及时发现过期药品。
8. 药品使用完,或者过期,空瓶、包装盒及说明书应在《销毁登记本》登记,并有2名护士签名。
(五)失效药品处理SOP
当医生确认患者不适合再次输注,或者药物存放不当失效,药品需要丢弃时,病房护士应将剩余药物置于双层黄色垃圾袋中,垃圾袋放置于感染性医疗废物桶内,由卫生员封闭并贴标识注明《含有少量药物垃圾》,由专人在防护下转运离开病房[6]。
推荐意见 1:乳腺癌靶向药物使用 SOP 分为6 个方面:靶向药物配置 SOP、靶向药物输注 SOP、急性反应应急预案 SOP、复输输注 SOP、余液管理SOP和失效药品处理SOP(共识度:100%)。
推荐意见 2:不同级别医院医院配置、输注依据医院条件不同,可病房配置或PIVAS配置。具有PIVAS 条件的医院,应严格执行 PIVAS 配置 SOP(共识度:100%)。
推荐意见 3:靶向药物输注 SOP遵循静脉输液流程(共识度:100%)。
推荐意见 4:药物输注过程中,如果患者发生输注反应,应立即采取急性反应应急预案,丢弃的药物按 余 药 处 理 流 程 进 行(共 识 度 :99%)。
推荐意见 5∶60 mg/瓶、150 mg/瓶规格的曲妥珠单抗、帕妥珠单抗和恩美曲妥珠单抗配置后立即使用,无需余药管理。为避免 440 mg(20 ml)/瓶规格曲妥珠单抗余液保存不当失效,应严格执行余药管理 SOP(共识度:95%)。
推荐意见 6:乳腺癌靶向药物需要丢弃时,按 照《医疗废物管理条例》(中华人民共和国国务院令第380)执行(共识度:98%)。
二、乳腺癌常用靶向药物静脉输注规范
(一)药物的配置要求
1. 即配即用管理[7‑9]:靶向药物应遵从即用即配原则,尽可能在接近给药时间时准备药物。抽出的药液和配制好待静脉输注用无菌液体,放置时间不应超过2 h;启封抽吸的各种溶媒不应超过24 h。
2. 静脉输注配制无菌规范:(1)静脉输液应遵循无菌技术原则,环境清洁,避免人群流动,防止尘埃飞扬,衣帽整洁,洗手[8];(2)无菌物品与非无菌物品应分开放置,无菌物品不可暴露在空气中[10]; (3)配置与使用静脉治疗药物,应在空气细菌总数≤ 4 CFU(5 min·直径 9 cm 平皿)的医疗环境内;有条件的医院可在配液中心配液[11];(4)给药前配制溶液和药物[12];(5)每次配制使用一个新的针头和注射器;单剂量药瓶一次插入后丢弃。多剂量药瓶只能用于 1 例患者,在多剂量药瓶上标记有效日期,并按照制造商的建议存储,若药瓶缺少有效期或被质疑超过了有效期必须丢弃[13]。
(二)药物规格
1. 曲妥珠单抗:目前国内临床上可供使用的注射用曲妥珠单抗有 440 mg(20 ml)/瓶、150 mg/瓶和60 mg/瓶3种规格a。
2. 帕妥珠单抗:420 mg(14 ml)/瓶a。
3. 恩美曲妥珠单抗:100 mg/瓶;160 mg/瓶a。
(三)药物配置
尽可能在 PIVAS 或符合静脉输注配制无菌规范的无菌环境中配制(准备、混合、包装和贴标签)药物[9]。曲妥珠单抗、帕妥珠单抗和恩美曲妥珠单抗等药物配置前,均需双人核对医嘱、查看药品名称和有效期,按照医嘱,使用合适的注射器抽吸出所需溶液的体积,不得与其他药物混合或使用其他药物稀释。注射用药物在输注前进行外观检查,确保药物溶液无微粒物质或者变色。440 mg(20 ml)/瓶规格曲妥珠单抗若为余药,需查看开启日期[14],超过28 d应丢弃。
1. 曲妥珠单抗注射液配置[14]:应采用正确的无菌操作,配制过程中,避免震荡产生过多泡沫,配制好的溶液若存在少量泡沫,可将西林瓶静止约5 min。配制好的 3 种规格的曲妥珠单抗最终浓度均为 21 mg/ml,pH 值约 6.0。(1)440 mg(20 ml)/瓶规格[14‑15]:20 ml专用溶媒缓慢注入曲妥珠单抗冻干粉瓶中,轻轻旋转药瓶,不得振摇或搅拌,避免产生过多泡沫。复溶过程中可能会出现起泡和浑浊,但静置约5 min后,泡沫会消散,溶液颜色应为澄清至浅白色。稀释液中含有少量苯甲醇,若患者对苯甲醇过敏,可以使用无菌注射用水进行复溶,但需要采用一次性使用药瓶。余药优先使用,执行查对制度。除三查九对外,还要检查余药储存的温度、首次配置的时间、颜色、有无冰冻、瓶塞有无漏气、沉 淀。(2)150 mg/瓶规格和 60 mg/瓶规格a:150 mg/瓶规格和 60 mg/瓶规格分别用 7.2 ml和 3.0 ml灭菌注射用水稀释。用无菌注射器将灭菌注射用水在装有曲妥珠单抗冻干粉的西林瓶中缓慢注入,直接注射在冻干药瓶中,轻轻旋动药瓶以帮助复溶,禁止剧烈震荡,配制成的溶液为无色至淡黄色的透明液体。溶液注射前应目测有无颗粒产生和变色点。
2. 帕妥珠单抗注射液配置a:西林瓶中抽出14 ml帕妥珠单抗浓缩液,沿壁注入 250 ml 0.9% 氯化钠聚氯乙烯(PVC)或非 PVC 聚烯烃输液袋中稀释,请勿振摇,避免起泡。配置好药液,应立即输注。
3. 恩美曲妥珠单抗注射液配置a:5 ml 无菌注射用水缓慢注入 100 mg的恩美曲妥珠单抗注射液西林瓶中,或将 8 ml 无菌注射用水注入 160 mg 的恩美曲妥珠单抗注射液西林瓶中,轻轻旋转西林瓶直至药物完全溶解,切勿用力摇晃,避免产生过多泡沫。从西林瓶中取出适量的溶液,然后将其添加到含有250 ml 0.45%或0.9%氯化钠的输液袋中。
恩美曲妥珠单抗输注装置使用0.9%氯化钠进行输注,则需要 0.2 μm 或 0.22 μm 的管内聚醚砜(PES)滤器的输液器a。
(四)药物用法、用量
1. 曲妥珠单抗[16‑17]:每周给药方案,初始负荷剂量为 4 mg/kg,维持剂量 2 mg/kg。首次静脉滴注(静滴)>90 min,以后静滴>30 min[14]。3 周给药方案,初始负荷剂量为 8 mg/kg,维持剂量 6 mg/kg,每 3 周给药 1 次。实际临床应用证明,适当延长静滴时间,能显著降低患者输注反应,因此,本共识制定专家组成员经过调研和讨论,确定3周给药首次静滴>180 min,以后静滴>120 min为佳a。
2. 帕妥珠单抗:护理人员在核对药物剂量时要了解帕妥珠单抗采用固定剂量给药,其推荐起始剂量为 840 mg,60 min 内静脉输注完毕,此后每 3 周给药 1次,给药剂量为 420 mg,30~60 min内静脉输注完毕a。护理人员要特别注意了解患者的治疗疗程,从而进一步核对患者的给药剂量[18]。
3. 恩美曲妥珠单抗:推荐剂量为 3.6 mg/kg,每 3 周 1 次,持续用药 14 个周期。首次给药:首次静滴>90 min,随后输注如以前输注耐受良好,可缩短至30 min滴完。
(五)用药前需对以下各项指标进行护理评估
1. 评估患者体重,核对医嘱中的药物剂量。
2. 评估患者主观意识和身体情况,包括患者意识状态、生命体征、对治疗的接受程度和合作程度等。
3. 评估患者药物过敏史,曲妥珠单抗需要询问酒精过敏史。
4. 核实检查结果及报告:核实患者超声心动检查、左心室射血分数(LVEF)、实验室检查结果及病理免疫组化报告中HER2的状态[15]。
5. 用药前,评估患者的静脉通路是否通畅[19]。
(六)药物的保存a
三类靶向药物在未开封前,均应放置于 2 ℃~8 ℃冷藏室中进行保存。复溶后的靶向药物只能稀释在0.9%氯化钠注射液中。
1. 曲妥珠单抗:(1)440 mg(20 ml)/瓶规格曲妥珠单抗用配套提供的稀释液溶解后,在2 ℃~8 ℃可稳定保存 28 d,可多次使用,28 d 后剩余的药液应弃用。苯甲醇过敏患者,应用无菌注射用水复溶,复溶后的溶液应被立即使用,弃去未使用部分。配制好的溶液应书写配置日期。(2)150 mg/瓶规格和60 mg/瓶规格曲妥珠单抗,要在严格无菌条件下操作,配制好的溶液可在 2 ℃~8 ℃条件下稳定保存48 h,不得冷冻;考虑到实际临床操作很难做到严格无菌,建议配置好的溶液立即使用,剩余药品丢弃。
2. 帕妥珠单抗必须确保已制备输液的无菌性,一旦制备好输液,应立即输注,若未立即使用可存放在2 ℃~8 ℃下不超过24 h。
3. 恩美曲妥珠单抗在 2 ℃~8 ℃下贮藏复溶的溶液,24 h后弃用。
(七)药物输注注意事项
1. 血管通路的选择:2种药物均可通过外周留置针、中心静脉导管等通路进行输注,输注前,需抽回血,判断血管是否通畅[18]。
2. 输注顺序:曲妥珠单抗和帕妥珠单抗必须序贯给药,但两者可按任意顺序给药;对于接受紫杉类药物治疗的患者,曲妥珠单抗和帕妥珠单抗给药应先于紫杉类药物;对于接受蒽环类药物治疗的患者,曲妥珠单抗和帕妥珠单抗应在完成完整蒽环类药物治疗方案后给予。
3. 密切观察患者反应:首次输注药物时,需给予心电监护,并定时巡视患者输液情况,严密观察患者输液反应,主动询问患者自我感受。首次给药后观察患者90 min内有无发热、寒战或其他输液相关反应,如患者出现输注相关症状,应按照急性反应应急预案流程处理,减慢输注速率或中断给药,出现危及生命的输液反应时,应终止治疗。
推荐意见 7:乳腺癌靶向药物配置遵从即用即配和无菌操作规范原则(共识度:98%)。
推荐意见 8:乳腺癌靶向药物配置尽可能在PIVAS或符合静脉输注配制无菌规范的无菌环境中进行。药物配置前,均需双人核对医嘱、查看药品名称和有效期;药物的配置和用法、用量应严格按照医嘱和使用说明书的要求执行(共识度:99%)。
推荐意见 9:曲妥珠单抗、帕妥珠单抗和恩美曲妥珠单抗三类靶向药物在未开封前,均应放置于2 ℃~8 ℃冷藏室中进行保存。复溶后的靶向药物只 能 稀 释 在 0.9% 氯 化 钠 注 射 液 中 。 440 mg(20 ml)/瓶规格曲妥珠单抗用配套提供的稀释液溶解后,在 2 ℃~8 ℃可稳定保存 28 d,可多次使用,28 d后剩余的药液应弃用,配制好的溶液应书写配置日期;150 mg/瓶规格和 60 mg/瓶规格曲妥珠单抗、帕妥珠单抗、恩美曲妥珠遵从即用即配原则,在严格无菌操作环境下,配置后未立即使用,或者剩余药品,可存放在2 ℃~8 ℃下不超过24 h(共识度99%)。
推荐意见 10:乳腺癌靶向药物用药前,需对患者从体重、主观意识和身体情况、药物过敏史、患者检查结果和报告以及患者静脉通路是否通畅等方面进行评估(共识度:99%)。
推荐意见 11:乳腺癌靶向药物输注前,需抽回血,判断血管是否通畅;输注时应注意输注顺序,并且在输注过程中密切观察反应,如患者出现输注相关症状,应按照急性反应应急预案流程处理(共识度:99%)。
三、不良反应的观察
(一)常规不良反应以下总结的常规不良反应在关键临床试验中以及临床应用中 3 种药物均出现频率较高的不良反应。
1. 输液相关反应:首次输注时可能会发生输液
相关的反应[20‑21],表现为以下一种或多种症状,如潮红、寒战、发热、呼吸困难、低血压、哮鸣、支气管痉挛和心动过速。出现的症状大部分在输液终止后数小时至 1 d 内痊愈[14]。在首次输注起始时,输液速度易慢,然后酌情加快输液速度至正常。
2. 急性过敏反应:患者出现面部潮红、支气管痉挛带来的呼吸困难及窘迫、低血压、心动过速、血氧饱和度下降、室上性快速性心律失常和荨麻疹等[15,22]状况,应立即停止输注,更换生理盐水,遵医嘱用药,给予心电监护密切观察患者生命体征及病情变化,做好详细的抢救记录。寒战患者应注意保暖;体温高可给予物理降温,并监测体温变化;同时做好复输准备,反应严重的禁止复输;丢弃的药物按余药处理流程进行处理[14‑15]。
3. 白细胞或中性粒细胞减少:通常在与化学治疗同时应用时出现。患者血常规监测异常,表现为乏力、发热、食欲减退[21]。
4. 胃肠道反应:患者出现恶心、呕吐、腹泻、便秘等表现[14,21‑24]。护士应做好健康宣教,指导患者做好饮食调整,建议少量多餐进食和饮水,出现严重腹泻时应及时就医,同时做好肛周护理。
5. 关节痛或肌肉痛:患者主诉关节部位僵硬及疼痛[21]。护士应做好运动指导,告知活动时注意事项,必要时遵医嘱服用止痛药物,做好服药指导。 6. 皮疹:皮疹发生率较为常见,有研究显示帕妥珠单抗治疗乳腺癌患者的皮疹发生率为 24.2%,而皮疹在双靶抗HER2联合化疗组中也更为常见,差异具有统计学意义。大多数事件的严重程度为1级或2级,发生在前两个周期[25‑26]。
(二)特别关注的不良反应
用药过程中,还需要特别关注每种靶向药物在临床中出现的特有不良反应[27‑33]。例如:输液部位渗漏、血液系统不良反应、心脏毒性等。常见血液系统不良反应包括贫血、中性粒细胞减少症和血小板减少症等[25]。抗 HER2靶向药物中,曲妥珠单抗和帕妥珠单抗治疗患者的血液学毒性较为少见, 3 级以上的血液学不良反应发生率均<1%,但与化疗联合时发生率升高[34]。
1. 输液部位渗漏:输注恩美曲妥珠单抗期间,如出现输液部位渗漏,患者局部会出现肿胀、发红,主诉疼痛或肿胀感觉[21]。护士应在输注过程中严密观察局部表现和主诉,一旦出现外渗应立即停止输液,拔除输液装置,根据外渗程度选择热敷、涂抹喜疗妥等措施进行处理[19]。
2. 血小板减少:恩美曲妥珠单抗最为常见的则为血小板减少症。输注恩美曲妥珠单抗期间,患者大多数会发生血小板降低事件。建议在每次给药之前监测血小板计数。若血小板计数降低达到≥ 3 级(<50 000/mm3),应暂停本品给药,直至血小板计数恢复至 1级(≥75 000/mm3)a。密切观察患者皮肤、黏膜有无出血点、瘀斑、血肿;观察鼻腔、牙龈是否有出血;询问患者是否有血便、血尿;观察呕吐物及排泄物的性质;月经来潮的患者要关注月经量变化;观察患者有无颅内出血征兆,如出现昏迷,心 跳、血压、呼吸不稳,或恶心、呕吐、腹泻等。
3. 心脏毒性:曲妥珠单抗可引起左心室功能不全、心律失常、高血压、有症状的心力衰竭、心肌病和心源性死亡,也可引起有症状的 LVEF 降低;曲妥珠单抗治疗患者发生充血性心力衰竭(CHF)或无症状心功能不全的风险增加[28‑29]。这些事件可见于接受曲妥珠单抗单药或含蒽环类化疗序贯曲妥珠单抗联合紫杉烷类治疗的患者。心功能不全可能从中度到重度并与死亡事件相关。心脏风险高(例如高血压、冠状动脉疾病、CHF、舒张功能不全、老年人)的患者需慎用。
推荐意见 12:输注过程中患者的不良反应包括常规不良反应和需要特别关注的不良反应。常规不良反应包括:输液相关反应、急性过敏反应、白细胞或中性粒细胞减少、胃肠道反应、关节痛或肌肉痛和皮疹等;特别关注的不良反应包括:输液部位渗漏、血小板减少、心脏毒性等。一旦患者出现不良反应,医护人员应立即采取措施,按照相应的处理措施进行处理(共识度:98%)。
四、药物健康宣教
(一)用药周期
向患者进行用药周期及使用时间的宣教,嘱咐患者按期入院治疗。用药周期见前文“药物用法、用量”章节。
(二)治疗方案
1. 早期乳腺癌:用于术前新辅助治疗时,建议患者接受 6~8 个周期曲妥珠单抗联合帕妥珠单抗的新辅助治疗,具体取决于和化疗联合治疗所选的方案;临床常用方案为:(1)4 周期蒽环药物+环磷酰胺,序贯 4 周期曲妥珠单抗+帕妥珠单抗+紫杉类;(2)6周期多西他赛+卡铂+曲妥珠单抗+帕妥珠单抗;对于既往接受新辅助治疗且术后无残存病灶的患者,在辅助治疗时应继续接受帕妥珠单抗联合曲妥珠单抗治疗,以完成 1 年的治疗疗程;对于既往接受新辅助治疗且术后仍存在残存病灶的患者,
应接受恩美曲妥珠单抗的辅助强化治疗 14 周期;对于未接受新辅助治疗,且伴高复发风险因素的患者,术后辅助治疗应选择帕妥珠单抗联合曲妥珠单抗治疗方案,每 3 周 1 次治疗,持续用药 1 年(最多18个周期)或至疾病复发或发生无法耐受的毒性。
2. 转移性乳腺癌:(1)一线治疗:帕妥珠单抗与曲妥珠单抗和紫杉类药物联合使用,直至出现疾病进展或不可耐受的毒性。治疗期间医师出于临床治疗需求停止紫杉类药物治疗,帕妥珠单抗与曲妥珠单抗的联合治疗仍可继续。(2)二线治疗:恩美曲妥珠单抗作为单药,适用于HER2阳性转移性乳腺癌的二线治疗,直至出现疾病进展或不可耐受的毒性。患者应有以下任一情况,选择二线治疗:①一线接受以曲妥珠单抗为基础的治疗后出现疾病进展;②辅助治疗期间复发或结束辅助治疗标准疗程12个月内出现疾病复发。
(三)不良反应观察
做好健康教育,与患者一起观察不良反应的发生。在用药过程中,如出现发热、寒战、头痛、呼吸困难或心脏不适等情况,应及时告知医务人员,并记录发生的时间和持续强度,同时做出相应的处理;在出院后若出现严重呕吐、腹泻、骨髓抑制或其他问题,也应及时返院就诊。
1. 血小板减少:用药期间如出现血小板减少情况,应注意休息,避免剧烈活动及碰伤,平时应穿着稍微宽大的衣服,保护皮肤完整性和清洁卫生;进食软食,避免吃粗硬的食物,预防胃肠道出血;建议用软毛牙刷刷牙,避免挤压鼻子、掏鼻孔;禁止热敷[35];每次用药前必须复查血常规,用药间歇期酌情增加血常规的监测频率,如每周监测;如发生出血,包括瘀斑、淤点,或血小板计数恢复缓慢,请及时联系医生,且必要时需转诊至血液科[21]。
2. 心脏毒性:心脏毒性通常表现为左心功能不全如 LVEF 下降、心律不齐、心肌病变、高血压等,严重时可发生CHF,甚至心脏性死亡。治疗前充分评估病史、体格检查、心电图、超声心动图、放射性核素血管扫描;治疗中每3个月复查LVEF;治疗后2 年内每 6 个月复测 LVEF。护士在每次输注前询问患者有无不适表现,如果一旦出现,应及时告知医生,参考心脏监测指数考虑治疗是否进行。
3. 恶心、呕吐:建议少量多餐进食,如每天 6~ 8 次加餐或小份餐;食物干湿分离,饭后不要立即平卧;安排好服药和进食的时间;呕吐期间,鼓励坚持饮水、果汁、清肉汤等,避免带气饮料;避免食用不宜消化的食物,少油腻如油炸食品、肥肉等。
推荐意见 13:应从用药周期、治疗方案、不良反应观察三个方面进行药物健康宣教(共识度:100%)。
推荐意见 14:为保证患者最佳用药时间,应向患者进行用药周期及使用时间的宣教,嘱咐患者按期入院治疗(共识度:100%)。
推荐意见 15:乳腺癌靶向药物治疗方案分为:早期乳腺癌治疗方案和转移性乳腺癌治疗方案。其中,转移性乳腺癌治疗方案又分为一线治疗和二线治疗。为保证患者的安全性和治疗效果,应对治疗方案进行宣教(共识度:95%)。
推荐意见 16:需对患者进行输注不良反应观察的健康宣教,包括血小板减少情况、心脏毒性情况和恶心、呕吐情况(共识度:97%)。
五、总结
近年来,随着对乳腺癌 HER2靶向治疗领域的持续研究,新的靶向治疗药物及治疗方案不断涌现,无疑给HER2阳性患者带来了福音。医护人员规范的临床护理操作技术是提高护理质量、保证用药安全和疗效的重要举措。中国医药教育协会乳腺癌个案管理师分会专家组成员借鉴国内、外HER2靶向药物输注临床实践经验,从靶向药物输注临床实际需求出发,起草、编制《共识》,对靶向药物静脉输注进行管理,有助于医护人员在靶向药物静脉输注方面提供标准化的指导和建议,保证药物的充分作用,达到真正的治疗目的,使患者从中获益。本文就《共识》调查问卷中存在的共性问题和新上市的 150 mg/瓶和 60 mg/瓶规格注射用曲妥珠单抗输注规范进行了更新,以供医护人员对临床可及的HER2靶向药物静脉输注操作规范进行参考。
共识制定委员会及专家组
顾问:王建东(解放军总医院第一医学中心)
执笔者:黄利虹(解放军总医院第一医学中心)
参与编写及讨论专家组成员(按姓氏拼音排序):方群英(中国科学院大学附属肿瘤医院);甘泉(解放军总医院第一医学中心);公连花(山东省临沂市人民医院);郭丝锦(空军军医大学第一附属医院);郭凌云(山西省肿瘤医院);黄利虹(解放军总医院第一医学中心);姜萍岚(中南大学湘雅医院);李倩(中山大学孙逸仙纪念医院);李丽莉(中国医科大学附属第一医院);刘芳(青岛大学附属医院乳腺病诊疗中心崂山院区);罗凤(重庆医科大学第一附属医院);梅志红(中国医学科学院肿瘤医院);彭爱荣(山东省淄博市中心医院);裘佳佳(上海复旦大学附属肿瘤医院);单会莲(中国医科大学盛京医院);王丹丹(解放军总医院第一医学中心);王建新(河北医科大学第四医院 河北省肿瘤医院);王萍(解放军总医院第一医学中心);王垣晓(云南省肿瘤医院);王影新(北京大学第一医院);吴家花(广东省中医院);尤渺宁 (北京大学肿瘤医院);于新颖(北京大学肿瘤医院);杨春敏(广东省中医院大学城医院);张惠婷(中山大学肿瘤防治中心);张静(解放军总医院第一医学中心);张男(上海交通大学附属瑞金医院);张志茹(吉林大学白求恩第一医院);赵岚(解放军总医院第一医学中心);赵权萍(北京大学人民医院);郑秋华(哈尔滨医科大学附属第二医院);朱富娣(哈尔滨医科大学附属肿瘤医院);朱艳(河南省肿瘤医院)
利益冲突 所有编写者均声明不存在利益冲突
注:a本文中曲妥珠单抗、帕妥珠单抗、恩美曲妥珠单抗靶向药物使用方法参考了 3种药物的使用说明书。注射用曲妥珠单抗说明书(上海复宏汉霖生物制药有限公司);注射用曲妥珠单抗(赫赛汀Herceptin)中文说明书(上海罗氏制药有限公司);注射用帕妥珠单抗中文说明书(上海罗氏制药有限公司);注射用恩美曲妥珠单抗
中文说明书(上海罗氏制药有限公司)
参 考 文 献
[1] Eiger D, Pondé NF, de Azambuja E. Pertuzumab in HER2‑positive early breast cancer: current use and perspectives[J]. Future Oncol, 2019, 15(16): 1823‑1843. DOI: 10.2217/fon‑2018‑0896.
[2] 中国临床肿瘤学会乳腺癌专家委员会, 中国抗癌协会乳腺癌专业委员会 .人表皮生长因子受体 2阳性乳腺癌临床诊疗专家共识(2021 版) [J]. 中华医学杂志, 2021, 101(17):1226‑1231.DOI: 10.3760/cma.j.cn112137‑20210318‑00679.
[3] 中国医药教育协会乳腺癌个案管理师分会.乳腺癌靶向药物静脉输注规范专家共识[J].中华医学杂志,2021,101(16):1143‑1148.DOI: 10.3760/cma.j.cn112137‑20201224‑03452.
[4] 国家卫生健康委员会办公厅. 静脉用药调配中心建设与管理 指 南 (试 行) [EB/OL]. (2021‑12‑20). http://www. nhc.
gov. cn/yzygj/s7659/202112/6fc8ae699c1f4fefb9e80a80d4f4fa55.shtml.
[5] 丘丽红, 钟就娣, 李传珍. 赫赛汀剩余药液在临床应用中的新实施方法[J]. 护士进修杂志, 2015, (2):123‑124. DOI:CNKI:SUN:FSJX.0.2015-02‑010.
[6] 中华人民共和国国务院令(第 380 号).《医疗废物管理条例》http://www.gov.cn/gongbao/content/2003/content_62236.htm. [7] 中华人民共和国卫生行业标准‑病区医院感染管理规(WS/T510‑2016). http://www. nhc. gov. cn/wjw/s9496/201701/d98872b367644755a5be80a69f5faf36.shtml. [8] 王建荣主编 .输液治疗护理实践指南与实施细则[M].人民军医出版社.2009.
[9] Gorski LA, Hadaway L, Hagle M E, et al. Infusion therapy standards of practice, 8th edition [J]. J Infusion Nurs,2021, 44:1‑224. DOI: 10.1097/NAN.0000000000000396.
[10] 中华人民共和国卫生部医政司. WS/T433‑2013 静脉治疗护理技术操作规范[S]. 北京, 2013.
[11] 中华人民共和国卫生部. WS/T367‑2012 医疗机构消毒技术规范[S]. 北京, 2012.
[12] Gorski LA, Hadaway L, Hagle ME, Infusion therapy standards of practice, 8th edition[J]. J Infus Nurs, 2021, 44(1S Suppl 1):180. DOI: 10.1097/NAN.0000000000000396.
[13] Gorski LA. The 2016 Infusion therapy standards of practice[J]. Home Healthc Now, 2017, 35(1): 10‑18. DOI:10.1097/NHH.0000000000000481.
[14] 彭昕,闻曲.乳腺癌病人应用赫赛汀的护理管理[J].护理研究,2014,28(1):84‑86.DOI:10.3969/j.issn.1009‑6493.2014.01.037.
[15] Frankel C. Nursing management considerations with trastuzumab (herceptin) [J]. Seminars in Oncology Nursing,2000, 16(Supp‑S):23‑28.DOI:10.1053/sonu.2000.19779.
[16] 江泽飞, 邵志敏, 徐兵河 . 人表皮生长因子受体 2阳性乳腺癌临床诊疗专家共识2016[J]. 中华医学杂志, 2016, 96(14):1091‑1096. DOI: 10.3760/cma.j.issn.0376‑2491.2016.14.006.
[17] 中国抗癌协会乳腺癌专业委员会. HER‑2阳性乳腺癌临床诊疗专家共识[J]. 中国癌症杂志, 2012, 22(4):314‑318.DOI: 10.3969/j.issn.1007‑3639.2012.04.015.
[18] Ng CM, Lum BL, Gimenez V, et al. Rationale for fixed dosing of pertuzumab in cancer patients based on population pharmacokinetic analysis[J]. Pharm Res, 2006,23(6):1275‑1284. DOI: 10.1007/s11095‑006‑0205‑x.
[19] Infusion Nurses Society. Infusion therapy standards of practice [G]. J Infus Nurs, 2016, 1S (39): S1‑S160.
[20] Thompson LM, Eckmann K, Boster BL, et al. Incidence,risk factors, and management of infusion‑related reactions in breast cancer patients receiving trastuzumab [J]. Oncologist, 2014, 19(3): 228‑234. DOI: 10.1634/theoncologist.2013‑0286.
[21] 中华医学会肿瘤学分会乳腺肿瘤学组, 中国乳腺癌靶向治疗药物安全性管理共识专家组. 中国乳腺癌靶向治疗药物安全性管理专家共识[J]. 中国癌症杂志, 2019, 29(12):993‑1006. DOI: 10.19401/j.cnki.1007‑3639.2019.12.013.
[22] Ishii K, Morii N, Yamashiro H. Pertuzumab in the treatment of HER2‑positive breast cancer: an evidence‑based review of its safety, efficacy, and place in therapy[J]. Core Evid, 2019, 14: 51‑70. DOI: 10.2147/CE. S217848.
[23] Yankulina O, Zullo AR, Cabral SE, et al.Pertuzumab‑associated diarrhea in HER2/neu‑positive breast cancer patients: a comparison of trials to actual
practice[J]. J Oncol Pharm Pract, 2020, 26(4): 912‑917.DOI: 10.1177/1078155219879211.
[24] Bines J, Procter M, Restuccia E, et al. Incidence and management of diarrhea with adjuvant pertuzumab and trastuzumab in patients with human epidermal growth factor receptor 2‑Positive breast cancer[J]. Clin Breast Cancer, 2020, 20(2): 174‑181. e3. DOI: 10.1016/j.clbc.2019.06.016.
[25] 李伟,刘梓良,王军,等.帕妥珠单抗治疗癌症的皮疹发生率及其发生风险的meta分析[J]. 华南国防医学杂志, 2014, 28(12):1227‑1231. DOI: 10.3969/j.issn.1009‑2595.2014.12.022.
[26] Drucker AM, Wu S, Dang CT, et al. Risk of rash with the anti‑HER2 dimerization antibody pertuzumab: a meta‑analysis[J]. Breast Cancer Res Treat, 2012, 135(2):347‑354. DOI: 10.1007/s10549‑012‑2157‑7.
[27] 曾化桂. HER‑2阳性乳腺癌抗HER‑2药物治疗的心脏毒性研究进展[J]. 临床肿瘤学杂志, 2017, 22(4):362‑368. DOI:10.3969/j.issn.1009‑0460.2017.04.015.
[28] 颜丽萍, 朱佳, 李德全, 等 . 联合使用曲妥珠单抗和帕妥珠单抗在乳腺癌患者中心脏毒性的 meta 分析[J]. 广西医科大 学 学 报 , 2014, 31(5): 792‑796. DOI: CNKI: SUN:GXYD.0.2014-05‑025.
[29] 焦苗苗 . 双靶联合化疗治疗 HER2阳性乳腺癌有效性和安全性的系统评价和 meta 分析[D]. 长春:吉林大学, 2020.DOI: 10.27162/d.cnki.gjlin.2020.003145.
[30] 程元甲, 徐玲, 叶京明, 等 . 帕妥珠单抗与曲妥珠单抗联合化疗在早期乳腺癌新辅助治疗中的疗效评价[J/CD]. 中华临 床 医 师 杂 志 ( 电 子 版), 2020, 14(5): 344‑348. DOI:10.3877/cma.j.issn.1674‑0785.2020.05.005.
[31] Gianni L, Pienkowski T, Im YH, et al. 5‑year analysis of neoadjuvant pertuzumab and trastuzumab in patients with locally advanced, inflammatory, or early‑stage HER2‑positive breast cancer (NeoSphere): a multicentre, open‑label, phase 2 randomised trial[J]. Lancet Oncol, 2016, 17(6): 791‑800. DOI: 10.1016/S1470‑2045(16) 00163‑7.
[32] Swain SM, Miles D, Kim SB, et al. Pertuzumab,trastuzumab, and docetaxel for HER2‑positive metastatic breast cancer (CLEOPATRA): end‑of‑study results from a double‑blind, randomised, placebo‑controlled, phase 3 study[J]. Lancet Oncol, 2020, 21(4): 519‑530. DOI:10.1016/S1470‑2045(19)30863‑0.
[33] Piccart M, Procter M, Fumagalli D, et al. Adjuvant pertuzumab and trastuzumab in early HER2‑positive breast cancer in the APHINITY trial: 6 Years′ pollow‑up[J].J Clin Oncol, 2021, 39(13): 1448-1457. DOI: 10.1200/JCO.20.01204.
[34] Sodergren SC, Copson E, White A, et al. Systematic review of the side effects associated with anti‑HER2‑targeted therapies used in the treatment of breast cancer, on behalf of the EORTC quality of life group[J]. Target Oncol,2016, 11(3):277‑292. DOI: 10.1007/s11523‑015‑0409‑2.
[35] 刘南主. 血液系统疾病综合诊疗要点(下) [M]. 长春:吉林科学技术出版社, 2016.
